ÁTOMO: Modelos Atômicos
A Química é uma ciência que estuda a natureza, as propriedades e a composição da matéria. Embora essa definição pareça algo "simples" ela é responsável por muitos questionamentos na cabeça das pessoas. Mas relaxa, esse questionamentos são comuns e frequentes desde a Grécia Antiga, onde tudo começou...
- A IDEIA PRIMITIVA DE LEUCIPO E DEMÓCRITO
Leucipo e Demócrito (por volta de 430 a.C. na Grécia Antiga) foram dois filósofos gregos e provavelmente as primeiras pessoas a idealizar o que seria o átomo. Para eles, tomando-se um corpo qualquer da matéria, poder-se-ia fragmentá-lo até que se chegasse a uma partícula tão pequena que fosse humanamente impossível de ser dividida. Essa partícula foi chamada de ÁTOMO (do grego A: não e TOMO:divisível, portanto não divisível). Entretanto, essas concepções apenas permaneceu no mundo das ideias e sem nenhum experimento que realmente o pudesse comprovar.
 Os anos foram se passando e as ideias que envolviam a determinação do que seria um ÁTOMO foram pouco exploradas. Entretanto, a partir do século XVIII, John Dalton baseado em experimentos de Lavoisier (Lei da Conservação das Massas) e de Proust (Lei das Proporções Definidas) criou a primeira Teoria Atômica para redefinir o conceito de átomo que ficou conhecida como Modelo da Bola de Bilhar.
Os anos foram se passando e as ideias que envolviam a determinação do que seria um ÁTOMO foram pouco exploradas. Entretanto, a partir do século XVIII, John Dalton baseado em experimentos de Lavoisier (Lei da Conservação das Massas) e de Proust (Lei das Proporções Definidas) criou a primeira Teoria Atômica para redefinir o conceito de átomo que ficou conhecida como Modelo da Bola de Bilhar.
Para Dalton:
1) Tudo na natureza seria formado por átomos.
2) Átomos não podem ser criados e nem destruídos.
3) Átomos iguais possuem propriedades iguais e átomos diferentes possuem propriedades diferentes.
4) Átomos podem se combinar para formar estruturas maiores e mais estáveis chamadas moléculas.
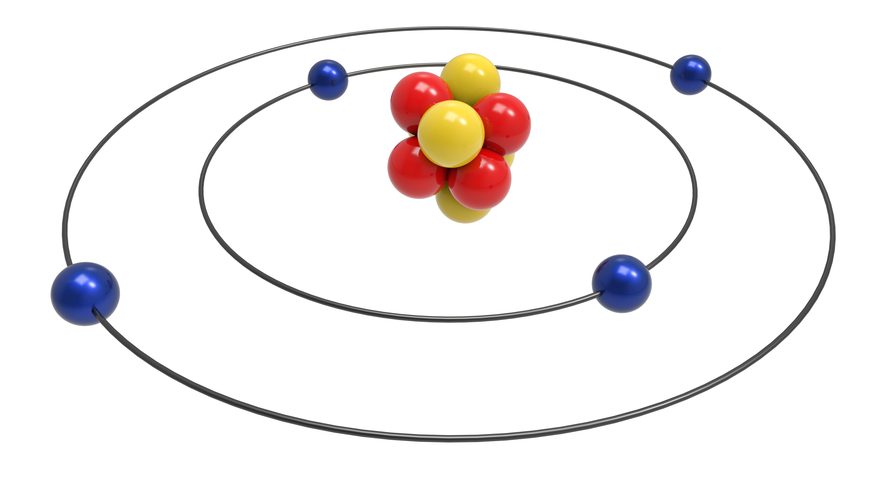
O modelo atômico de Bohr ficou conhecido como Modelo Nuclear . Para Bohr:
 1) Os elétrons que giram ao redor do núcleo não giram ao acaso, mas descrevem órbitas determinadas.
1) Os elétrons que giram ao redor do núcleo não giram ao acaso, mas descrevem órbitas determinadas.
2) O átomo é incrivelmente pequeno e ainda assim boa parte de seu volume é vazio.
3) Os elétrons se movimentam tão rapidamente que praticamente preenchem todo o espaço vazio.
4) Quando um elétron recebe energia (como de uma fonte elétrica) ele salta para uma órbita* mais externa e retorna para a sua órbita de energia liberando luz.
* as definições do que é a orbita serão dadas na aula de Números Quânticos.
- O MODELO ATÔMICO DE DALTON: A BOLA DE BILHAR
 Os anos foram se passando e as ideias que envolviam a determinação do que seria um ÁTOMO foram pouco exploradas. Entretanto, a partir do século XVIII, John Dalton baseado em experimentos de Lavoisier (Lei da Conservação das Massas) e de Proust (Lei das Proporções Definidas) criou a primeira Teoria Atômica para redefinir o conceito de átomo que ficou conhecida como Modelo da Bola de Bilhar.
Os anos foram se passando e as ideias que envolviam a determinação do que seria um ÁTOMO foram pouco exploradas. Entretanto, a partir do século XVIII, John Dalton baseado em experimentos de Lavoisier (Lei da Conservação das Massas) e de Proust (Lei das Proporções Definidas) criou a primeira Teoria Atômica para redefinir o conceito de átomo que ficou conhecida como Modelo da Bola de Bilhar.Para Dalton:
1) Tudo na natureza seria formado por átomos.
2) Átomos não podem ser criados e nem destruídos.
3) Átomos iguais possuem propriedades iguais e átomos diferentes possuem propriedades diferentes.
4) Átomos podem se combinar para formar estruturas maiores e mais estáveis chamadas moléculas.
- MODELO ATÔMICO DE THOMSON: O PUDIM DE PASSAS
O modelo atômico de Thomson ficou conhecido como Modelo do Pudim de Passas devido as propriedades da matéria observadas em experimentos de importantes cientistas dos século XIX. Para Thomson, o átomo:
1) Possui natureza elétrica.
2) É divisível (contrariando os modelos atômicos de Dalton e dos gregos Leucipo e Demócrito).
Mas como ele chegou nestas conclusões?
O tubo de Crookes - apresentado no gif abaixo - é um experimento onde um gás é submetido a uma baixa pressão e alta tensão. A descarga elétrica promove a ionização do gás e consequentemente a liberação de um feixe luminoso. Esse feixe independe do gás ou elemento a ser ionizado.
Entretanto, Thomson (baseado em diversos outros cientistas e experimentos) percebeu que esse feixe quando submetido a um campo magnético externo (como um imã) apresentava desvio de linearidade/direção. Nesta observação, Thomson concluiu que as partículas deveriam portanto possuir cargas e que o átomo deveria ser constituído uniformemente por partículas positivas e negativas.
Por ter estabelecido a natureza elétrica da matéria, Thomson foi reconhecido como PAI DO ELÉTRON.
Entretanto, Thomson (baseado em diversos outros cientistas e experimentos) percebeu que esse feixe quando submetido a um campo magnético externo (como um imã) apresentava desvio de linearidade/direção. Nesta observação, Thomson concluiu que as partículas deveriam portanto possuir cargas e que o átomo deveria ser constituído uniformemente por partículas positivas e negativas.
Por ter estabelecido a natureza elétrica da matéria, Thomson foi reconhecido como PAI DO ELÉTRON.
- MODELO ATÔMICO DE RUTHERFORD: MODELO PLANETÁRIO
O modelo atômico de Rutherford ficou conhecido como Modelo do Planetário que corresponderia a um sistema planetário em miniatura onde os elétrons se movem em orbitas ao redor de um núcleo. Para Rutherford, o átomo:
1) Possui um núcleo denso e pequeno de carga líquida positiva.
2) Os elétrons de carga negativa orbitam esse núcleo.

- MODELO ATÔMICO DE BOHR: MODELO NUCLEAR
O modelo atômico de Bohr ficou conhecido como Modelo Nuclear . Para Bohr:
 1) Os elétrons que giram ao redor do núcleo não giram ao acaso, mas descrevem órbitas determinadas.
1) Os elétrons que giram ao redor do núcleo não giram ao acaso, mas descrevem órbitas determinadas.2) O átomo é incrivelmente pequeno e ainda assim boa parte de seu volume é vazio.
3) Os elétrons se movimentam tão rapidamente que praticamente preenchem todo o espaço vazio.
4) Quando um elétron recebe energia (como de uma fonte elétrica) ele salta para uma órbita* mais externa e retorna para a sua órbita de energia liberando luz.
* as definições do que é a orbita serão dadas na aula de Números Quânticos.
EXERCÍCIOS SOBRE O TEMA:
1) Uma importante contribuição do modelo de Rutherford foi considerar o átomo constituído de:
a) elétrons mergulhados numa massa homogênea de carga positiva.
b) uma estrutura altamente compactada de prótons e elétrons.
c) um núcleo de massa desprezível comparada com a massa do elétron.
d) uma região central com carga negativa chamada núcleo.
e) um núcleo muito pequeno de carga positiva, cercada por elétrons.
2) Relacione as características atômicas com os cientistas que as propôs:
I. Dalton
II. Thomson
III. Rutherford
( ) Seu modelo atômico era semelhante a um “pudim de passas”.
( ) Seu modelo atômico era semelhante a uma bola de bilhar.
( ) Criou um modelo para o átomo semelhante ao “Sistema solar”.
3) O átomo de Rutherford (1911) foi comparado ao sistema planetário (o núcleo atômico representa o sol e a eletrosfera, os planetas):
Eletrosfera é a região do átomo que:
a) contém as partículas de carga elétrica negativa.
b) contém as partículas de carga elétrica positiva.
c) contém nêutrons.
d) concentra praticamente toda a massa do átomo.
e) contém prótons e nêutrons.
4) Ao longo dos anos, as características atômicas foram sendo desvendadas pelos cientistas. Foi um processo de descoberta no qual as opiniões anteriores não poderiam ser desprezadas, ou seja, apesar de serem ideias ultrapassadas, fizeram parte do histórico de descoberta das características atômicas.
Vários foram os colaboradores para o modelo atômico atual, dentre eles Dalton, Thomson, Rutherford e Bohr. Abaixo você tem a relação de algumas características atômicas, especifique o cientista responsável por cada uma destas teorias:
I. O átomo é comparado a uma bola de bilhar: uma esfera maciça, homogênea, indivisível, indestrutível e eletricamente neutra.
II. O átomo é comparado a um pudim de ameixas: uma esfera carregada positivamente e que elétrons de carga negativa ficam incrustados nela.
III. Átomo em que os elétrons se organizam na forma de camadas ao redor do núcleo.
III. Átomo que apresenta um núcleo carregado positivamente e ao seu redor gira elétrons com carga negativa.
5) O primeiro modelo científico para o átomo foi proposto por Dalton em 1808. Este modelo foi comparado a:
a) Uma bola de tênis;
b) Uma bola de futebol;
c) Uma bola de pingue-pongue;
d) Uma bola de bilhar;
e) Uma bexiga cheia de ar.
6) (UFTM-MG)Fogos de artifício utilizam sais de diferentes íons metálicos misturados com um material explosivo. Quando incendiados, emitem diferentes colorações. Por exemplo: sais de sódio emitem cor amarela, de bário, cor verde, e de cobre, cor azul. Essas cores são produzidas quando os elétrons excitados dos íons metálicos retornam para níveis de menor energia. O modelo atômico mais adequado para explicar esse fenômeno é o modelo de:
a) Rutherford.
b) Rutherford-Bohr.
c) Thomson.
d) Dalton.
e) Millikan.




Comentários
Postar um comentário