NÚMEROS QUÂNTICOS
Em nossa aula de Modelos Atômicos (não acessou? Clica aqui!) vimos que por toda a história diversos filósofos e cientistas tentaram descrever a matéria e a sua composição. Embora diversas teorias e modelos tenham sido criados, hoje o Modelo Atômico da Mecânica Quântica desenvolvido inicialmente por Bohr e comprovado matematicamente por Schrodinger é o aceito na comunidade científica.
Obviamente, você, caro vestibulando, não precisa conhecer a fundo as teorias quânticas e a matemática envolvida nos cálculos. Todavia, para nosso alcance e aplicabilidade, devemos tomar conhecimento dos Quatro Números Quânticos derivados da Mecânica Quântica.
Os Quatro Números Quânticos
A teoria quântica nos demonstra que a matéria possui propriedades associadas com a ondulatória de partículas. Dessa forma, não podemos determinar com precisão a posição exata de um elétron e muito menos sua velocidade e direção. Essa afirmação é definida como o Princípio da Incerteza de Heisenberg.
Entretanto, podemos determinar possíveis espaços (que chamamos de orbitais) onde temos uma maior probabilidade de se encontrar um elétron. Estes orbitais nos permitem dizer uma posição relativa do elétron no espaço por intermédio de 4 números quânticos:
- n → Número Quântico Principal
- l → Número Quântico Secundário (ou azimutal)
- m →Número Quântico Magnético
- s → Número Quântico Spin
1) Número Quântico Principal (n)
Definido pela letra n (minúscula), o Número Quântico Principal define o nível de energia dos elétrons. Estes níveis correspondem as camadas eletrônicas e podem ser compreendidas como a distância que o elétron está em relação ao núcleo.
Como observado no esquema acima, cada camada é representada por uma letra entre K e Q, e por um nível de energia n de 1 a 7.
2) Número Quântico Secundário (l):
Definido pela letra l (minúscula), o Número Quântico Secundário define o subnível de energia de um elétron. Os subníveis são descritos pela Mecânica Quântica pela expressão l=n-1. Dessa forma:
- Para o nível de energia n = 1, temos: l = 1 - 1 = 0
- Ou seja, o nível contempla apenas o subnível 0.
- Para o nível de energia n = 2, temos: l = 2 - 1 = 1
- Ou seja, o nível contempla apenas os subníveis 0 e 1.
- Para o nível de energia n = 3, temos: l = 3 - 1 = 2
- Ou seja, o nível contempla apenas os subníveis 0, 1 e 2.
Para cada valor de l que possa ser obtido na expressão l=n-1 temos uma letra associada.
Como pode ser observado na tabela acima, os subníveis g, h e i existem teoricamente. Todavia, ainda não há comprovações científicas de elementos que possam ter elétrons nestes subníveis.Desta forma, reduzimos nosso campo de estudos aos subníveis s , p, d e f !
Para estes subníveis temos os seguintes valores:
3) Número Quântico Magnético (m)
Definido pela letra m (minúscula), o Número Quântico Magnético define a orientação dos orbitais no espaço.
Para encontrarmos o número quântico associado a cada subnível consideramos a seguinte expressão: m= ±l .
Para encontrarmos o número quântico associado a cada subnível consideramos a seguinte expressão: m= ±l .
(Calma, parece confuso mas vamos entender o que está acontecendo...)
- Quando tratamos do subnível s, estamos falando de um valor de l que equivale a 0 (conforme falamos no número quântico secundário). Logo, m irá variar de -0 a +0. Como não existe essa possibilidade + e -, m = 0.
- Quando tratamos do subnível p, estamos falando de um valor de l que equivale a 1. Logo, m irá variar de -1 a +1. Dessa forma, m será descrito por m = -1, 0 e +1.
- Quando tratamos do subnível d, estamos falando de um valor de l que equivale a 2. Logo, m irá variar de -2 a +2. Dessa forma, m será descrito por m = -2, -1, 0, +1 e +2.
- Quando tratamos do subnível f, estamos falando de um valor de l que equivale a 3. Logo, m irá variar de -3 a +3. Dessa forma, m será descrito por m = -3, -2, -1, 0, +1, +2 e +3.
Em resumo:
Uma vez que cada orbital pode conter no máximo 2 elétrons temos que o subnível s pode ter até 2 elétrons, o subnível p até 6, o subnível d até 10 e o subnível f até 14 elétrons!
4) Número Quântico Spin (s):
Definido pela letra s (minúscula), o Número Quântico Spin define o sentido de rotação do elétron. O valor pode ser positivo de +1/2 ou negativo de -1/2.
Essa rotação do elétron faz com que ele se comporte como se fosse um pequeno imã, criando uma espécie de campo magnético. Uma vez que os opostos se atraem dois elétrons somente estarão em um mesmo orbital (representado pelas caixinhas que vimos no Número Quântico Magnético) se estiverem com spins opostos (os opostos se atraem e os iguais se repelem).
Importante lembrar que quando falamos em orbitais estamos descrevendo eles como se fossem caixinhas, aquelas que desenhamos no número quântico m. Cada caixinha, um orbital. Cada orbital, no máximo dois elétrons de sentidos opostos.
Vejamos alguns exemplos para compreender como aplicar os números quânticos.
Exemplos para Números Quânticos
Exemplo 01 - Quais os números quânticos do subnível 4p5?
Etapa 01 - O número 4 representa nosso Número Quântico Principal (que chamamos de n). Logo, n = 4.
Etapa 02 - A letra p representa nosso Número Quântico Secundário (que chamamos de l). Logo, l = 1.
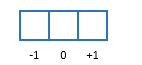
Etapa 03 - Se nosso valor de l é 1, temos que nosso Número Quântico Magnético (que chamamos de m) irá variar de -1 a +1.
Etapa 04 - Desenhamos os orbitais de m variando de -1 a +1.
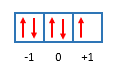
Etapa 05 - Distribuímos os elétrons nestes orbitais. Colocamos primeiro todos os elétrons representando eles como setas para cima.
Etapa 06 - Colocando as setas para cima, uma em cada caixinha, utilizamos 3 dos 5 elétrons do 4p5. Agora, devemos colocar os outros 2 elétrons ( 5 - 3 = 2 ) com a seta virada para baixo.
Etapa 07 - Colocamos, portanto, os 5 elétrons (representados como setinhas) nos 3 orbitais (representados como caixinhas). Nosso último elétron adicionado, que foi com a setinha para baixo, ocorreu no orbital 0. Dessa forma, o Número Quântico Magnético (m) será 0. Como a setinha foi para baixo, o Número Quântico Spin (s) será -1/2.
Portanto, os números quânticos para 4p5 serão:
Exemplo 02 - Quais os números quânticos do subnível 5d4?
Etapa 01 - O número 5 representa nosso Número Quântico Principal (que chamamos de n). Logo, n = 5.
Etapa 02 - A letra d representa nosso Número Quântico Secundário (que chamamos de l). Logo, l = 2.
Etapa 03 - Se nosso valor de l é 2, temos que nosso Número Quântico Magnético (que chamamos de m) irá variar de -2 a +2.
Etapa 04 - Desenhamos os orbitais de m variando de -2 a +2.
Etapa 05 - Distribuímos os elétrons nestes orbitais. Colocamos primeiro todos os elétrons representando eles como setas para cima.
Etapa 06 - Colocando as setas para cima, uma em cada caixinha, utilizamos 4 dos 4 elétrons do 5d4. Como todos os elétrons já foram colocados não temos nenhum para colocar como setinha para baixo.
Etapa 07 - Colocamos, portanto, os 4 elétrons (representados como setinhas) nos 5 orbitais (representados como caixinhas). Nosso último elétron adicionado, que foi com a setinha para cima, ocorreu no orbital +1. Dessa forma, o Número Quântico Magnético (m) será +1. Como a setinha foi para cima, o Número Quântico Spin (s) será +1/2.
Portanto, os números quânticos para 5d4 serão:
MAPA MENTAL DE NÚMEROS QUÂNTICOS
EXERCÍCIOS SOBRE O TEMA
Parte 01: Exercícios para treinar.
1) Quais os números quânticos dos subníveis abaixo?
a) 3d6
b) 1s2
c) 5p4
d) 7s1
e) 2p2
2) Dado elemento químico possui números quânticos n=3, l=1, m=-1 e s=-1/2. Qual o subnível dele?
3) Quantos orbitais preenchidos com dois elétrons tem o subnível 2p5?
4) O número máximo de elétrons no subnível f é 10. Tal afirmação é verdadeira ou falsa? Justifique.
Parte 02: Exercícios de vestibulares
1) De acordo com o modelo atômico atual, a disposição dos elétrons em torno do núcleo ocorre em diferentes estados energéticos, os quais são caracterizados pelo número quântico principal e secundário. Para o elétron mais energético do átomo de escândio no estado fundamental, os números quânticos principal e secundário são, respectivamente: (Z = 21 e camada de valência em 3d1)
a) 3 e 0b) 3 e 2
c) 4 e 0
d) 4 e 2
2) A principal aplicação do bromo é a produção de brometo de etileno, que é utilizado em combustíveis para motores com o intuito de evitar a acumulação de chumbo no interior dos cilindros. Considerando que o número atômico do bromo é 35 (4p5), afirma-se que ele possui:
I. O número quântico principal igual a 4.
II. 3 orbitais completos.
III. 5 elétrons no nível de valência.
IV. O número quântico magnético igual a 0.
V. 7 elétrons na última camada, com número quântico azimutal igual a 1.
Estão corretas apenas as afirmativas
a) I e IV.
b) I, II e V.
c) III, IV e V.
d) I, II, IV e V.
GABARITO:
Parte 01:
1)
a) n= 3 , l= 2 , m= -2 , s= -1/2
b) n= 1 , l= 0 , m= 0 , s= -1/2
c) n= 5 , l= 1 , m= -1 , s= -1/2
d) n= 7 , l= 0 , m= 0 , s= +1/2
e) n= 2 , l= 1 , m= 0 , s= +1/2
2) 3p4
3) 2 orbitais preenchidos com dois elétrons e 1 orbital com um elétron.
4) Falsa. O orbital f pode contemplar até 14 elétrons emparelhados.
Parte 02:
1) Letra b: 3 e 2
2) Letra d
I. O número quântico principal igual a 4.
II. 3 orbitais completos.
III. 5 elétrons no nível de valência.
IV. O número quântico magnético igual a 0.
V. 7 elétrons na última camada, com número quântico azimutal igual a 1.
Estão corretas apenas as afirmativas
a) I e IV.
b) I, II e V.
c) III, IV e V.
d) I, II, IV e V.
GABARITO:
Parte 01:
1)
a) n= 3 , l= 2 , m= -2 , s= -1/2
b) n= 1 , l= 0 , m= 0 , s= -1/2
c) n= 5 , l= 1 , m= -1 , s= -1/2
d) n= 7 , l= 0 , m= 0 , s= +1/2
e) n= 2 , l= 1 , m= 0 , s= +1/2
2) 3p4
3) 2 orbitais preenchidos com dois elétrons e 1 orbital com um elétron.
4) Falsa. O orbital f pode contemplar até 14 elétrons emparelhados.
Parte 02:
1) Letra b: 3 e 2
2) Letra d














Comentários
Postar um comentário