Estrutura de átomo moderno
O átomo moderno se baseia em diversos fundamentos da mecânica ondulatória e mecânica quântica (vale lembrar que se a palavrinha quântica estiver relacionada a algo que não seja física ou química, considere que é fake!).
Entretanto, para fins didáticos, o modelo atômico de Rutherford ainda é o mais utilizado. Nele, agora, também consideramos a presença do neutron (uma partícula neutra descoberta por Chadwick em 1932).
Mas, afinal, como é o átomo moderno?
- O PRÓTON (na figura acima representado como a esfera de cor preta) é uma partícula de carga POSITIVA localizada no NÚCLEO do átomo. Adotamos para ele uma massa relativa que equivale a 1 unidade.
- O NÊUTRON (na figura acima representado como a esfera de cor azul) é uma partícula de carga neutra localizada no NÚCLEO do átomo. Adotamos para ele uma massa relativa que equivale a 1 unidade.
- O ELÉTRON (na figura acima representado como a esfera de cor branca com sinal - em vermelho) é uma partícula de carga negativa localizada na ELETROSFERA do átomo. Todavia, sua massa é equivalente a 1/1836 unidades e consideramos - portanto - desprezível, quando comparado à massa de um NEUTRON e de um PRÓTON.
Número Atômico - definido pela letra Z
Sempre que alguém te perguntar o que diferencia os átomos uns dos outros responda - com toda a certeza - que é o NÚMERO ATÔMICO. Isso acontece uma vez que o NÚMERO ATÔMICO é definido como o número de PRÓTONS no núcleo de um determinado elemento químico e este número nunca vai variar em reações químicas (exceto em reações nucleares da Radioatividade).
ÁTOMOS COM O MESMO NÚMERO DE PRÓTONS POSSUEM AS MESMAS CARACTERÍSTICAS!!!
Número de massa - definido pela letra A
Vimos alguns parágrafos acima que a massa do ELÉTRON é considerada desprezível por ser muito pequena. Dessa forma, o número de massa de um dado elemento químico é feito pela soma do número de PRÓTONS e número de NÊUTRONS.
Átomo neutro e íon
Átomo neutro: o número de prótons é igual ao número de elétrons. Como a quantidade de partículas positivas é igual ao número de partículas negativas a soma da zero.
Por exemplo, suponha um átomo com 5 prótons e 5 elétrons. Temos, portanto, + 5 - 5 = 0
Íon: quando o número de prótons é diferente do número de elétrons. Como a quantidade de partículas positivas e negativas é diferente, a carga elétrica líquida não mais será zero.
Por exemplo, vamos pensar no átomo neutro do exemplo anterior:
* Se ele ganhar 2 elétrons terá 5 prótons e 7 elétrons. Portanto, + 5 - 7 = -2. Como ele tem carga é um íon e como a carga é negativa chamamos ele de ÂNION.
* Se ele perder 2 elétrons terá 5 prótons e 3 elétrons. Portanto, + 5 - 3 = +2. Como ele tem carga é um íon e como a carga é positiva chamamos ele de CÁTION.
CÁLCULO DA P.A.N.E
Particularmente, eu gosto de chamar esse cálculo de PANE.
O P de PANE corresponde ao número de PRÓTONS que como vimos alguns parágrafos acima é a mesma coisa que NÚMERO ATÔMICO (aquela definição que vem definir o que é o nosso elemento químico!).
O A de PANE corresponde ao NÚMERO DE MASSA de um elemento químico. Lembrando que o NÚMERO DE MASSA é pela soma do número de PRÓTONS e NÊUTRONS (a massa do ELÉTRONS é desprezível!).
O N de PANE corresponde ao número de NÊUTRONS. Você pode obter o número de nêutrons pela diferença entre a NÚMERO DE MASSA e o NÚMERO ATÔMICO (massa menos prótons).
O E de PANE corresponde ao número de ELÉTRONS. O número de elétrons para um átomo neutro é igual ao número de prótons. Se o elemento for um íon, esse número irá variar.
EXEMPLO
1) Calcular o número atômico, número de massa, prótons, nêutrons e elétrons de cada elemento abaixo:
Resolução Comentada:
No exemplo acima temos o elemento químico ALUMÍNIO (representado pelas letras A maiúscula e L minúscula). O número 13 do lado de cima indica que seu número atômico é 13 e que seu número de massa é 27.
Partindo dessa colocação, iniciamos o cálculo do P.A.N.E.
Letra P de P.A.N.E. = A letra P representa o número de prótons. Precisamos lembrar que o número de prótons é equivalente ao número atômico. Se o número atômico é 13 o número de prótons também será 13.
Letra A de P.A.N.E. = A letra A corresponde ao número de massa. O número de massa é o valor de baixo da representação. Portanto, o número de massa do Alumínio é 27.
Letra N de P.A.N.E. = A letra N corresponde ao número de neutrons. Os neutrons são partículas pesadas no núcleo do átomo. Se o número de massa é 27 e o elemento possui 13 prótons, para descobrir o número de neutrons basta subtrair: 27 - 13 = 14 neutrons.
Letra E de P.A.N.E. = A letra E corresponde ao número de elétrons. Como o elemento é neutro (ou seja não possui carga + e nem carga - ) o número de prótons será igual ao número de elétrons. Portanto, se ele tem 13 prótons ele também terá 13 elétrons.
Resolução Comentada:
No exemplo acima temos o elemento químico ENXOFRE (representado pela letra S maiúscula). O número 16 indica que seu número atômico é 16, o número de baixo que seu número de massa é 32 e a indicação 2- que ele é um íon.
Partindo dessa colocação, iniciamos o cálculo do P.A.N.E.
Letra P de P.A.N.E. = A letra P representa o número de prótons. Precisamos lembrar que o número de prótons é equivalente ao número atômico. Se o número atômico é 16 o número de prótons também será 16.
Letra A de P.A.N.E. = A letra A corresponde ao número de massa. O número de massa é o valor de baixo da representação. Portanto, o número de massa do Enxofre é 32.
Letra N de P.A.N.E. = A letra N corresponde ao número de neutrons. Os neutrons são partículas pesadas no núcleo do átomo. Se o número de massa é 32 e o elemento possui 16 prótons, para descobrir o número de neutrons basta subtrair: 32 - 16 = 16 neutrons.
Letra E de P.A.N.E. = A letra E corresponde ao número de elétrons. Como o elemento é um íon precisamos entender o que aconteceu com o número de elétrons desse átomo. Primeiramente, se ele está com carga negativa (na representação marcada como "dois menos") quer dizer que o elemento ganhou dois elétrons (se o elemento ganhar elétrons a carga é negativa; se ele perde a carga é positiva) e é portanto chamado de ÂNION. Se ele fosse um átomo neutro, ele teria 16 elétrons. Mas como ele é um ânion que ganhou 2 elétrons (carga dois menos) ele possui 18 elétrons.
MAPA MENTAL PARA O ÁTOMO
EXERCÍCIOS SOBRE O TEMA
1) Qual o número de massa (A) de um átomo de cálcio (Z = 20) com 20 nêutrons?
2) O número atômico (Z) e o número de massa (A) de um íon monoatômico com carga 3+ que contém 10 elétrons e 14 nêutrons são, respectivamente:
a) 13, 27b) 24, 21
c) 14, 24
d) 13, 24
e) 14, 27
3) (UFG – GO) O número de prótons, nêutrons e elétrons representados por 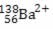 é, respectivamente:
é, respectivamente:
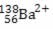 é, respectivamente:
é, respectivamente:a) 56, 82 e 56
b) 56, 82 e 54
c) 56, 82 e 58
d) 82, 138 e 56
e) 82, 194 e 56
4) (Unifor – CE) Dentre as espécies químicas:
5B9 5B10 5B11 6C10 6C12 6C14
as que representam átomos cujos núcleos possuem 6 nêutrons são:
a) 6C10 6C12
b) 5B11 6C12
c) 5B10 5B11
d) 5B9 6C14
e) 5B10 6C14
5) Um átomo é constituído por 28 elétrons e possui número de massa igual a 50. Assinale a alternativa que apresenta seu número atômico e seu número de nêutrons, respectivamente.
a) 26 e 24
b) 28 e 50
c) 28 e 22
d) 19 e 40
e) 26 e 20
6) Em um átomo que apresenta 40 elétrons e 65 nêutrons, podemos afirmar que seu número de prótons é igual a:
a) 25
b) 40
c) 65
d) 105
e) nda.
7) (UFPI-PI) A representação 26Fe56 indica que o átomo do elemento químico ferro apresenta a seguinte composição nuclear:
a) 26 prótons, 26 elétrons e 30 nêutrons
b) 26 elétrons e 30 nêutrons
c) 26 prótons, 26 elétrons e 56 nêutrons
d) 26 prótons e 26 elétrons
e) 26 prótons e 30 nêutrons
a) 62
b) 58
c) 74
d) 42
e) 92






Comentários
Postar um comentário