Propriedades dos Ácidos de Arrhenius
Sempre que mencionamos sobre ácidos é comum que em nossa mente tenhamos a ideia de que estamos falando de substâncias/compostos tóxicos ou corrosivos. Embora muitos ácidos realmente tenham uma elevada capacidade de corrosão estes compostos são extremamente importantes para nossa existência.
Ácidos atualmente podem ser encontrados em refrigerantes, medicamentos, alimentos e produtos de higiene. O próprio DNA é um ácido (Ácido Desoxirribonucleico)!
Nesta aula-resumo estaremos abordando as principais propriedades/características destes compostos.
Propriedades Gerais dos ácidos:
- Ácidos possuem sabor azedo.
Mas cuidado! Apesar de possuírem um sabor azedo isso não significa que todos os ácidos podem ser ingeridos. A definição de sabor "azedo" se dá em função dos ácidos que são encontrados nos alimentos como Ácido Cítrico (do limão) e Ácido Acético (do vinagre).
Não coloque qualquer ácido na boca!

- Ácidos conduzem eletricidade em meio aquoso.
Para conduzir eletricidade uma solução deve conter íons (cátions e ânions) que permitam a passagem de corrente elétrica. Uma vez que ácidos se ionizam produzindo íons em solução estes compostos conduzem eletricidade!
- Ácidos alteram a cor de substâncias indicadoras.
Substâncias indicadoras são substâncias que quando submetidas a soluções com compostos ácidos ou bases mudam de cor. Essa mudança de cor possibilita que saibamos se aquela solução é ácida ou básica sem que seja necessária a realização de experimentos mais aprofundados ou complexos.
Um dos exemplos encontrados na natureza de indicadores ácido base são as flores de Hortência. Quanto mais ácido for o solo mais para o azul serão as flores. Quanto mais básico for o solo mais para o rosa serão as flores. Os exemplos aplicados na química e usuais para os exercícios serão abordados na aula de pH.
- Ácidos reagem com bases.
Os ácidos reagem com as bases por meio de uma reação descrita como Reação de Neutralização. Esta reação será estudada com mais detalhes na aula resumo de Reações Inorgânicas.
- Ácidos se ionizam gerando H+ como único cátion em solução.
Pela definição de Arrhenius, ácidos são compostos que se ionizam em solução liberando como único cátion o íon H+ que também pode ser representado como íon Hidrônio (H3O+).
Classificação dos ácidos: Presença de Oxigênio
Hidrácidos são os ácidos que não possuem Oxigênio na molécula. São substâncias formadas por Hidrogênio e um Ametal.
São exemplos:
Oxiácidos são os ácidos que possuem Oxigênio na molécula.
São exemplos:
Volatilidade é a capacidade que uma substância tem de evaporar. Desta forma, nesta classificação estamos abordando a capacidade que um ácido tem de passar do estado líquido para o estado gasoso!
Ácidos Voláteis: dos ácidos inorgânicos são voláteis apenas os ácidos Fluorídrico, Clorídrico, Bromídrico, Iodídrico, Cianídrico e Sulfídrico. A fórmula destes ácidos são apresentadas, respectivamente, abaixo:
Ácidos Fixos: dos ácidos inorgânicos são fixos a maioria dos ácidos. São ácidos que possuem um elevado ponto de ebulição. Abaixo são apresentados alguns destes ácidos como Ácido Sulfúrico, Fosfórico e Bórico, respectivamente.
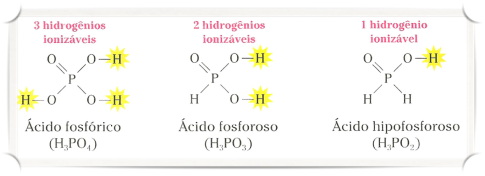
Hidrogênio Ionizável é o hidrogênio proveniente de um ácido e que é capaz de formar um hidrônio (H3O+). Em uma linguagem mais simples é todo aquele Hidrogênio Ácido liberado como cátion após ionização do ácido.
Nos Hidrácidos TODOS os hidrogênios são ionizáveis!
Nos Oxiácidos APENAS os hidrogênios ligados a oxigênios são ionizáveis!
Observem que na imagem acima temos a representação de três oxiácidos: Ácido Fosfórico, Ácido Fosforoso e Ácido Hipofosforoso.
Entretanto, embora os três ácidos tenham 3 Hidrogênios cada um a quantidade de Hidrogênios Ionizáveis é diferente já que nem todos estão ligados a oxigênios.
"Mas, Maycon, isso é importante?"
A resposta é sim!
A quantidade de Hidrogênios Ionizáveis é importante para a descrição da FORÇA de um ácido!
A força de um ácido (descrita pela letra alfa) é calculada através da divisão entre o número de moléculas ionizadas e o número de moléculas dissolvidas.
Se o valor calculado para α for:
- Entre 0 e 0,05 (ou seja, entre 0 e 5%) o ácido é fraco.
- Entre 0,05 e 0,5 (ou seja, entre 5 e 50%) o ácido é moderado.
- Entre 0,5 e 1,0 (ou seja, entre 50 e 100%) o ácido é forte.
ATENÇÃO:
Em muitos exercícios contudo não são fornecidos os dados para efetivação do cálculo de α e se torna necessário memorizar quais ácidos INORGÂNICOS são fortes, moderados ou fracos.
ATENÇÃO NA DICA:
Para os Hidrácidos:
- Fortes: HCl, HI e HBr.
- Moderados: HF
- Fracos: Os demais ácidos Inorgânicos
Para os Oxiácidos:
Realizamos o cálculo do número de oxigênios menos o número de hidrogênios. Se o resultado dessa subtração for:
- 3 ou mais: Oxiácido Muito Forte
- 2: Oxiácido Forte
- 1: Oxiácido Moderado
- 0: Oxiácido Fraco
Para auxiliar nos estudos:
Exercícios para treinar
1) (ESAL-MG) Uma solução aquosa de Ácido Fosfórico é ácida devido à presença de:
a) Água
b) Hidrogênio
c) Fósforo
d) Hidrônio
e) Fosfato
2) Os ácidos, segundo a teoria de dissociação de Arrhenius, são compostos moleculares que, ao serem dissolvidos em água, geram íons H+(aq). Como é chamado o processo de formação de íons que ocorre quando um ácido é dissolvido em água?
a) Dissociação iônica
b) Ionização
c) Eletrólise
d) Hidratação
e) Eletrolítica
3) Com relação aos oxiácidos, sabe-se que ácidos com sufixo "oso" apresentam um oxigênio a menos que os terminados com "ico". Com base nisso, assinale a alternativa que completa corretamente os espaços em branco na tabela abaixo respectivamente:
a) H2NO3, ácido fosforídrico, ácido sulfuroso
b) HNO2, ácido fosforídrico, ácido sulfuroso
c) H2NO3, ácido fosfórico, ácido sulfídrico
d) HNO2, ácido fosfórico, ácido sulfuroso
e) H2NO3, ácido fosfórico, ácido sulfuroso
4) (ITA-SP) Qual dos ácidos a seguir é o menos volátil?
a) HCl
b) HI
c) H2SO3
d) H2SO4
e) CH3-CH2-COOH
5) (USTJ-SP) O ácido cianídrico é o gás de ação venenosa mais rápida que se conhece: uma concentração de 0,3 mg por litro de ar é imediatamente mortal. É o gás usado nos estados americanos do Norte, que adotam a pena de morte por câmara de gás. A primeira vítima foi seu descobridor, Carl Wilhelm Sheele, que morreu ao deixar cair um vidro contendo solução de ácido cianídrico, cuja fórmula molecular é:
a) HCOOH
b) HCN
c) HCNS
d) HCNO
e) H4Fe(CN)6
Gabarito:
1) D
1) D
2) B
3) D
4) D
5) B





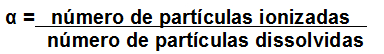


Comentários
Postar um comentário