Distribuição Eletrônica
Prezado estudante,
Antes de iniciar mais uma aula resumo do nosso "Nera para ser Química" gostaria de dizer que o tema de hoje está INTEIRAMENTE relacionado a última aula sobre Números Quânticos. Caso não tenha acessado e realizado os exercícios, clique aqui antes de continuar.
Na aula de "Números Quânticos" vimos que é possível determinar um orbital (região com maior probabilidade de se encontrar um determinado elétron) desde que ele seja identificado por meio de quatro números quânticos (n, l, m e s).
Neste aspecto de "conhecer o elétron" se torna necessário - contudo - organizar os elétrons em função da energia (escalada em função dos subníveis energéticos).
Decorar e compreender a ordem de energia é um trabalho exaustivo e muitas vezes confuso. Porém, para facilitar a nossa vida, o químico norte-americano Linus Pauling criou um diagrama prático para se visualizar a sequência energética dos diferentes subníveis.
Diagrama de Linus Pauling
Fonte da imagem: Sistema de Ensino Poliedro
Por intermédio do Diagrama de Linus Pauling (apresentado na imagem acima) a distribuição eletrônica para qualquer elemento químico pode ser facilmente realizada desde que tenhamos conhecimento do número total de elétrons do átomo em estudo e utilizemos a ordem estabelecida pelas setas.
Vejamos alguns exemplos:
Qual a distribuição eletrônica para o Cálcio?
O Cálcio (Ca) apresenta 40 de Número de Massa (A) e 20 de Número Atômico (Z).
O Número Atômico é o mesmo que o número de Prótons e - para um átomo neutro - este número é o mesmo que a quantidade de elétrons no átomo. Dessa forma, o Cálcio possui 20 elétrons.
Utilizamos a ordem das setas do Diagrama de Linus Pauling até atingirmos o número 20.
Dessa forma, a distribuição eletrônica do Cálcio é:
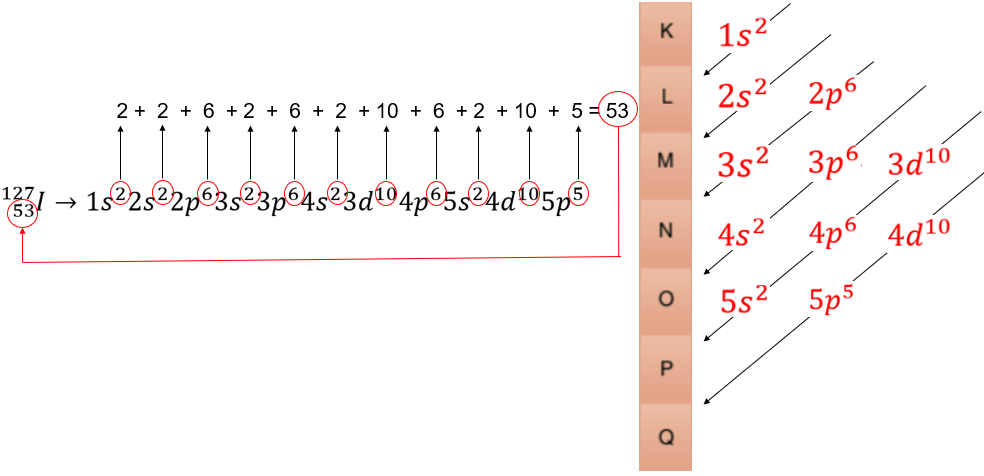
Qual a distribuição eletrônica para o Iodo?
O Iodo (I) apresenta 127 de Número de Massa (A) e 53 de Número Atômico (Z).
O Número Atômico é o mesmo que o número de Prótons e - para um átomo neutro - este número é o mesmo que a quantidade de elétrons no átomo. Dessa forma, o Iodo possui 53 elétrons.
Utilizamos a ordem das setas do Diagrama de Linus Pauling até atingirmos o número 53.
Dessa forma a distribuição eletrônica do Iodo é:
"Mas, Maycon, o subnível 5p comporta 6 elétrons. Eu posso colocar apenas 5?"
Esta é uma das dúvidas mais frequentes e um dos erros mais comuns na distribuição eletrônica. Precisamos lembrar que o número de elétrons em cada subnível nunca pode ultrapassar o máximo permitido mas podemos colocar menos elétrons no ÚLTIMO subnível para atingir a contagem total que queremos.
Ou seja:
- Quando o número quântico secundário for s podemos colocar 1 ou 2 elétrons.
- Quando o número quântico secundário for p podemos colocar 1, 2, 3, 4, 5 ou 6 elétrons.
- Quando o número quântico secundário for d podemos colocar 1, 2, 3, 4, 5, 6, 7, 8, 9 ou 10 elétrons.
- Quando o número quântico secundário for f podemos colocar 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 ou 14 elétrons.
"Mas, Maycon, até agora consideramos nos exemplos apenas átomos neutros. E se por um acaso meu átomo for um íon?"
Neste caso fazemos a distribuição eletrônica do átomo considerando todos os elétrons e depois adicionamos ou retiramos elétrons na última camada!
Vejamos alguns exemplos:
Qual a distribuição eletrônica para o cátion bivalente de Cálcio?
Como vimos anteriormente, o Cálcio apresenta 20 elétrons e possui distribuição eletrônica:
Entretanto, agora observamos que nosso elemento não é mais um átomo neutro mas sim um cátion bivalente, ou seja, possui a carga 2+. Este valor (2+) indica que nosso elemento perdeu elétrons (não se recorda o que são cátions e ânions? Dê uma olhada na aula de Átomo Moderno clicando aqui).
"Mas de onde retirar esses dois elétrons?"
Estes elétrons devem ser retirados da ÚLTIMA CAMADA e não do último subnível energético. Dessa forma, observando a distribuição eletrônica do Cálcio concluímos que a última camada é a 4.
Desta forma temos que a distribuição eletrônica do cátion bivalente de Cálcio é:
Qual a distribuição eletrônica para ânion monovalente de Iodo?
Como vimos anteriormente, o Iodo apresenta 53 elétrons e possui distribuição eletrônica:
Entretanto, agora observamos que nosso elemento não é mais um átomo neutro mas sim um ânion monovalente, ou seja, possui a carga 1-. Este valor (1-) indica que nosso elemento ganhou um elétron.
"Mas onde colocar esse elétron a mais?"
Este elétron deve ser colocado na ÚLTIMA CAMADA incompleta ou no próximo subnível disponível. Dessa forma, observando a distribuição eletrônica do Iodo concluímos que a última camada é a 5.
Desta forma temos que a distribuição eletrônica do ânion monovalente de Iodo é:
Exceções na Distribuição Eletrônica
Alguns elementos possuem desvios entre a distribuição eletrônica esperada pelo Diagrama de Linus Pauling e a observada experimentalmente.
O Cobre (Cu) é um dos elementos em que podemos encontrar essa divergência. Abaixo podemos observar a Distribuição Eletrônica Esperada e a Distribuição Eletrônica Observada.
"Mas, Maycon, qual o motivo disso acontecer?"
Inicialmente esse desvio pode até ser confuso e um pouco assustador mas veremos que é bem lógico o fundamento teórico que rege essa mudança.
Na Distribuição Eletrônica Esperada temos que no subnível d da camada 3 são distribuídos 9 elétrons de modo que o orbital de número quântico magnético +2 fique com apenas 1 elétron. Ademais nota-se que o subnível s da camada 4 contém um orbital completamente preenchido com 2 elétrons. Uma vez que a camada 4 está mais externa que a camada 3, o elétron de número quântico spin +1/2 migra para o orbital de m=+2 da camada 3. Desta forma, a Distribuição Eletrônica Observada para o Cobre é 3d10 4s1.
"Em quais elementos é observado este desvio?"
Este desvio é observado em elementos de transição em que a distribuição eletrônica termine em (n-1)d9 ns2 (como o Cobre que é 3d9 4s2 ) no qual a configuração mais estável é 3d10 4s1 ; e naqueles elementos que terminem em (n-1)d4 ns2 (como o Cromo que é 3d4 4s2 ) no qual a configuração mais estável é é 3d5 4s1.
Camada de Valência
A Camada de Valência é definida como a última camada ocupada por elétrons.
Para o Cálcio, por exemplo, temos que a camada de valência é 4s2 enquanto para o Iodo é 5s2 5p5.
Subnível mais Energético
O Subnível mais Energético é definido como o último subnível escrito após distribuição eletrônica de um dado elemento químico.
Para o Cálcio, por exemplo, temos que o subnível mais energético é o 4s2 enquanto para o Iodo o 5p5.
Propriedades Magnéticas
Este tópico objetiva descrever as propriedades magnéticas dos elementos químicos.
Uma vez que os elétrons estão em movimento precisamos retomar conceitos da Física que nos dizem que quando cargas são colocadas em movimento teremos geração de campo magnético.
Entretanto quando os elétrons estão distribuídos nos orbitais ocorrem duas possibilidades de efeitos magnéticos:
- Efeito Paramagnético: quando há algum orbital com apenas um elétron (chamamos este elétron desemparelhado) e haverá interação com campos magnéticos.
- Efeito Diamagnético: quando há somente orbitais totalmente preenchidos (chamamos estes elétrons de emparelhados) e haverá fraca interação com campos magnéticos.
Mapa Mental de Distribuição Eletrônica
EXERCÍCIOS SOBRE O TEMA
1) (ACAFE) Considerando-se um elemento M genérico qualquer, que apresenta configuração eletrônica 1s2 2s2 2p6 3s2 3p6 4s2 3d5, pode-se afirmar que:
I. seu número atômico é 25;
II. possui 7 elétrons na última camada;
III. apresenta 5 elétrons desemparelhados;
IV. pertencem a família 7A.
Estão corretas as afirmações:
a) I, II e III somente
b) I e III somente
c) II e IV somente
d) I e IV somente
e) II, III e IV somente
2) (UFSC) O número de elétrons em cada subnível do átomo estrôncio (38Sr) em ordem crescente de energia é:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
3) (ITA) O número máximo de orbitais atômicos correspondente ao número quântico principal é:
a) n
b) 2n
c) 2n + 1
d) n2
e) 2n2
4) (CESCEM) Qual dos valores abaixo pode representar o número atômico de um átomo que, no estado fundamental, apresenta apenas dois elétrons de valência?
a) 16
b) 17
c) 18
d) 19
e) 20
5) (AMAN-SP) - O elemento hipotético com nº atômico (Z = 116) apresenta na camada mais externa (camada de valência) um número de elétrons igual a:
a) 2
b) 4
c) 6
d) 8
e) 18
6) (Unificado-RJ) - As torcidas vêm colorindo cada vez mais os estádios de futebol com fogos de artifício. Sabemos que as cores desses fogos devem-se à presença de certos elementos químicos. Um dos mais usados para obter a cor vermelha é o estrôncio (Z = 38), que, na forma do íon Sr+2, tem a seguinte configuração eletrônica:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
b) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
c) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 5p2
d) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4d2
e) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4 5s2
7) (OSEC) - Sendo o subnível 4s1 (com um elétron) o mais energético de um átomo, podemos afirmar que:
I. o número total de elétrons desse átomo é igual a 19;
II. esse apresenta quatro camadas eletrônicas;
III. a sua configuração eletrônica é 1s2 2s2 2p6 3s2 3p6 3d10 4s1
a)Apenas a firmação I é correta.
b)Apenas a firmação II é correta.
c)Apenas a firmação III é correta.
d)As afirmações II e III são corretas.
e)As afirmações I e II são corretas.
8) (FM Petrópolis RJ/2013) - O chumbo é um metal pesado que pode contaminar o ar, o solo, os rios e alimentos. A absorção de quantidades pequenas de chumbo por longos períodos pode levar a uma toxicidade crônica, que se manifesta de várias formas, especialmente afetando o sistema nervoso, sendo as crianças as principais vítimas. Sendo o número atômico (Z) do chumbo igual a 82, o íon plumboso (Pb+2) possui os elétrons mais energéticos no subnível
a) 6p2
b) 6s2
c) 6p4
d) 5d10
e) 4f14
9) (Unifor-CE) - O átomo de um elemento químico tem 14 elétrons no terceiro nível energético (n = 3). O número atômico desse elemento é:
a) 14
b) 16
c) 24
d) 26
e) 36
10) (Unaerp-SP) - O fenômeno da supercondução de eletricidade, descoberto em 1911, voltou a ser objeto da atenção do mundo científico com a constatação de Bednorz e Muller de que materiais cerâmicos podem exibir esse tipo de comportamento, valendo um prêmio Nobel a esses físicos em 1987. Um dos elementos químicos mais importantes na formulação da cerâmica supercondutora é o ÍTRIO:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d1.
O número de camadas e o número de elétrons mais energéticos para o ítrio serão, respectivamente:
a) 4 e 1.
b) 5 e 1.
c) 4 e 2.
d) 5 e 3.
e) 4 e 3.
GABARITO:
1) B
2) A
3) D
4) E
5) C
6) A
7) E
8) B
9) D
10) B




















Comentários
Postar um comentário